С. Е. Павлов, РГМУ, Москва
Применение неинвазивных (прежде всего — транскутанного) методов лазерного воздействия перспективно и логично, особенно если учесть высокую проникающую способность лазерного излучения в биологические ткани и простоту проведения таких процедур. Не менее важно отсутствие каких-либо субъективных ощущений у больного во время подобных сеансов лазеротерапии.
В основу проводимого нами исследования положена гипотеза о возможности обратного развития отдельных патологических процессов в организме человека.
Выбор низкоэнергетического лазерного излучения в качестве средства воздействия обусловлен, с одной стороны, механизмами его действия [1, 12, 14, 15, 22] на целостный организм как высокоорганизованную, неравновесную, самоструктурирующуюся и самоорганизующуюся систему [10], с другой — данными многочисленных лабораторных и клинических исследований, доказывающих эффективность использования низкоэнергетических лазеров в лечении патологии гепатобилиарной системы.
Эксперименты на животных [6, 8] и клинические исследования [18, 20] позволили выявить нормализующее влияние лазерного излучения на функцию гепатоцитов.
Имеются данные о положительном влиянии лазерного излучения (при использовании инвазивного метода воздействия) на физико-химические параметры желчи (электропроводность, показатель преломления, диэлектрическая проводимость, вязкость, рН, поверхностное натяжение, время нуклеации и др.) больных желчнокаменной болезнью [4]. Многочисленны сообщения об эффективном использовании инвазивных методов гелий-неонового лазерного воздействия в клинике острого и хронического холецистита [5, 7, 11, 13, 19, 21]. Курсовое лазерное воздействие (гелий-неоновый лазер) на зоны Захарьина — Геда и биологически активные точки у больных с патологией желчевыводящих путей способствовало нормализации сократительной функции желчного пузыря, уменьшению проявлений воспалительного процесса [9]. Сравнительный анализ эффективности различных видов лазерного излучения (сравнивались гелий-неоновый лазер, лазер на парах меди, азотный лазер и галлий-арсенидовый лазер) при использовании транскутанного метода воздействия в эксперименте на крысах выявил наибольшие положительные сдвиги при использовании галлий-арсенидового лазера [6]. Отмечено, что наименьшей оптической плотностью обладают биологические ткани для длин волн 0,7-1,4 мкм, т. е. в красном и в ближнем инфракрасном диапазоне [12].
Применение неинвазивных (прежде всего — транскутанного) методов лазерного воздействия более перспективно и логично, особенно если учесть высокую проникающую способность лазерного излучения в биологические ткани и простоту проведения таких процедур. Не менее важно отсутствие каких-либо субъективных ощущений у больного во время подобных сеансов лазеротерапии. Следует сказать, что использование транскутанных методов лазерного воздействия предъявляет специфические требования к лазерной медицинской аппаратуре. Более эффективным оказывается применение галлий-арсенидовых низкоэнергетических медицинских лазерных аппаратов с матричными излучателями и большой площадью (до 8-20 см2) излучающей поверхности [16, 17].
В нашем исследовании мы использовали портативный терапевтический лазерный аппарат “Биномм” импульсного действия с шестью галий-арсенидовыми излучателями и площадью излучающей поверхности 12 см2. В качестве метода воздействия было выбрано сочетанное применение методов полизонального последовательного транскутанного лазерного воздействия на сосудисто-нервные сплетения [17] и лазерного воздействия на анатомические проекции печени (правой доли) и желчного пузыря. Проведение сеансов лазеротерапии (ежедневно) тесно увязывалось с приемами пищи, что обосновано с точки зрения концепции П. К. Анохина (1975, 1980) о механизме формирования функциональных систем. Суммарные и зональные дозы лазерного воздействия варьировались на протяжении курса лечения в связи с прогностическим моделированием терапевтического результата на основе динамики состояния больного. Длительность курса определялась возрастом и состоянием больного, клинической картиной заболевания, количеством и размерами конкрементов и не была ограничена общепринятыми временными рамками проведения курса физиотерапевтических процедур.
Этапные результаты исследования представлены на примере больной Т. Ф-ко, 37 лет, готовившейся к плановому хирургическому лечению по поводу желчнокаменной болезни, осложненной хроническим холециститом.
Перед началом курса лазеротерапии больная предъявляла жалобы на общее нарушение самочувствия, чувство тяжести и постоянные тянущие боли в правом подреберье, диспептические расстройства. Больная на протяжении длительного времени пользовалась болеутоляющими, спазмолитическими и ферментными препаратами. Проведенное ультразвуковое исследование выявило деформацию и эхо-признаки воспаления стенки желчного пузыря, наличие конкремента в желчном пузыре, расширение печеночных желчных протоков. Неподвижность конкремента при смене положений тела больной свидетельствовало о его спаянности со стенкой желчного пузыря. Максимальный размер конкремента в исходном (до начала курса лазеротерапии) ультразвуковом исследовании составил 18,3 мм (рис. 1).
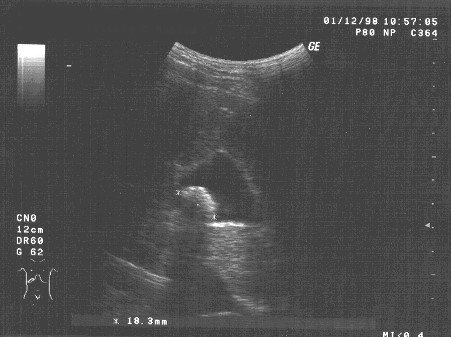 Рисунок 1. Исходные (до начала курса лазеротерапии) данные ультразвукового исследования желчного пузыря больной Т. Ф-ко
Рисунок 1. Исходные (до начала курса лазеротерапии) данные ультразвукового исследования желчного пузыря больной Т. Ф-ко
В условия проводимого исследования не входило прекращение приема фармакологических препаратов, ранее назначенных гастроэнтерологом в качестве симптоматического лечения. Тем не менее больная уже после второго сеанса лазеротерапии самостоятельно отказалась от приема всех ранее принимавшихся регулярно лекарственных средств в связи с полным отсутствием уже на этой стадии лечения болевого синдрома, нормализацией функций кишечника, улучшением общего состояния. На протяжении 2,5 недели ежедневного лазерного воздействия по предложенной нами схеме отсутствовали какие-либо жалобы на плохое самочувствие. Незначительные транзиторные болевые ощущения были отмечены лишь к концу третьей недели лазеротерапии, накануне контрольного ультразвукового исследования.
Ультразвуковое исследование, выполненное примерно через три недели после начала ежедневных лазеротерапевтических процедур, выявило уменьшение эхо-признаков воспалительной реакции в стенке желчного пузыря, абсолютную подвижность и незначительное уменьшение размеров конкремента: максимальный размер — 16,4 мм. При этом отмечено некоторое изменение эхо-структуры конкремента (рис. 2). Отсутствовала динамика в величине просвета печеночных желчных протоков.
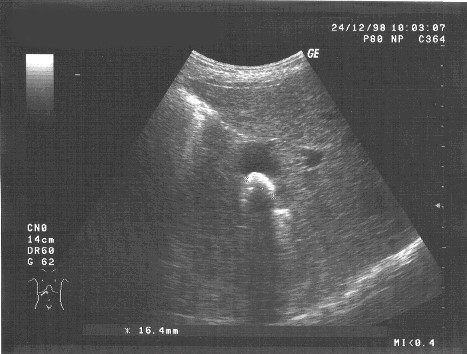 Рис. 2. Контрольное (второе) ультразвуковое исследование желчного пузыря больной Т.Ф-ко
Рис. 2. Контрольное (второе) ультразвуковое исследование желчного пузыря больной Т.Ф-ко
На следующем двухнедельном этапе лечения разовые зональные и соответственно суммарная дозы лазерного воздействия были снижены вдвое по сравнению с дозами, использовавшимися на первоначальном этапе. На протяжении всего этого периода лечения, вопреки ожидаемому (в связи с подвижностью конкремента), отмечено полное отсутствие болевого синдрома, отсутствие жалоб больной на функцию пищеварительного тракта и общее самочувствие, даже на фоне эпизодического грубого нарушения диеты.
Данные последующего (третьего) ультразвукового исследования выявили практическое отсутствие эхо-признаков воспалительного процесса стенки желчного пузыря, сохранение подвижности конкремента и уменьшение его максимального размера до 11,2 мм (рис. 3). Ультразвуковое исследование после пищевой нагрузки свидетельствует о некоторой гиперкинетичности стенки желчного пузыря (сокращение объема желчного пузыря до 1/2 от исходного). Отмечено отсутствие динамики (по сравнению с предыдущими исследованиями) величины просвета печеночных желчных протоков. Сохранялась деформация стенок желчного пузыря, что несколько осложнило определение его объемов.
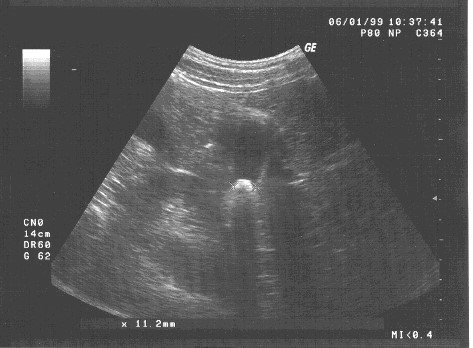 Рис. 3. Этапное (третье) ультразвуковое исследование желчного пузыря больной Т. Ф-ко
Рис. 3. Этапное (третье) ультразвуковое исследование желчного пузыря больной Т. Ф-ко
Наблюдение за пациенткой в течение последующих двух недель во время перерыва в курсе лечения позволило отметить полное отсутствие болевого синдрома и субъективно (со слов больной) — стабилизацию общего состояния на удовлетворительном уровне.
Предварительные результаты настоящего исследования органично укладываются в гипотезу о возможности обратного развития отдельных патологических процессов в организме человека при условии адекватного изменения состояния внутренней среды организма.
Предполагается, что сроки деструкции конкремента в желчном пузыре при создании соответствующих условий адекватны срокам его формирования и — не исключено — напрямую связаны в том числе с длительностью индивидуального, генетически обусловленного периода адаптации организма к изменениям (в связи с лечебным воздействием), в данном случае — в гепатобилиарной системе организма. Длительность курса физиотерапевтического (и не только!) лечения (при безошибочном выборе средств и методов воздействия) не должна ограничиваться общепринятыми в физиотерапии временными рамками. Она определяется сроками адаптации организма больного к изменяющимся в процессе лечения условиям существования организма.
Результаты исследования не противоречат данным многочисленных исследований о возможности использования эффектов взаимодействия лазерного излучения с организмом человека в терапии воспалительных процессов стенки желчного пузыря. Вместе с тем хотелось бы еще раз подчеркнуть, что нами были использованы неинвазивные, транскутанные методы лазерного воздействия.
Не исключено, что сократимость стенки желчного пузыря не играет ведущей роли в патогенезе желчнокаменной болезни. Тем не менее нормализация ее сократимости после курсового лечения с использованием низкоэнергетических лазеров открывает дополнительные позитивные перспективы в клинике данного заболевания.
Уменьшение размеров конкремента в процессе лазеротерапии (при его абсолютной подвижности) увеличивает риск его “вклинивания” в ductus choledochus. Поэтому есть основания предполагать, что в практическом плане наиболее перспективно сочетанное использование органосохраняющего эндоскопического хирургического метода (холецистостомия с эвакуацией конкрементов) и лазеротерапии. Такой сочетанный органосохраняющий и менее травматичный вариант лечения желчнокаменной болезни может явиться весомой альтернативой широко применяющейся холецистэктомии. И тем не менее даже несмотря на недостаточность клинического опыта консервативного лечения желчнокаменной болезни с использованием низкоэнергетических лазеров, представленные результаты свидетельствуют о возможности развития такого направления в клинике.
Павлов С. Е. Исследование возможности консервативного лечения желчнокаменной болезни с использованием низкоэнергетического лазера. – «Лечащий врач», 1999. — N 6. — С. 55-58
1. Александров М. Т. Основы лазерной клинической биофотометрии. 1991.
2. Анохин П. К. Очерки по физиологии функциональных систем. 1975.
3. Анохин П. К. Узловые вопросы теории функциональной системы. 1980.
4. Баракаев С. Б., Джураев Х. Ш. Динамика физико-химических свойств желчи под влиянием гелий-неонового лазера. 1988.
5. Брискин Б. С., Минасян А. М., Елисеенко В. И. Лазерное облучение в сочетании с микрохолецистостомией при остром холецистите. 1992.
6. Ворожейкин В. М., Артыков Ш. Н. Влияние разных видов низкоинтенсивного лазерного излучения на структуру печени в норме и при экспериментальной патологии. 1991.
7. Грубник В. В., Золотарев Т. А. и др. Возможности использования полупроводникового лазера у больных холециститом. 1992.
8. Ивушкин С. А., Александров М. Т., Плаксина Г. В., Тимакова В. С., Дроздова Г. А., Римарчук Г. В., Лапрун И. В., Изучение действия лазерного излучения на морфофункциональное состояние ткани печени неполовозрелых крыс на модели экспериментального гепатоза. 1992.
9. Ермолов С. Ю., Радченко В. Г., Жигалин А. С., Креслина В. А. Использование низкоинтенсивного лазерного излучения при лечении заболеваний биллиарной системы. 1992.
10. Илларионов В. Е. Методологические основы теории и практики лечебного применения низкоэнергетического лазерного излучения. 1992.
11. Ильхамов Ф. А., Вахидов А. В., Агзамов А. И., Юсупов А. К. Возможности полилазерного воздействия в хирургии печени и желчевыводящих путей. 1991.
12. Корепанов В. И. Руководство по лазерной терапии. 1995.
13. Корпан Н. Н., Макеев А. Ф., Рустамов И. Р., Абдуганиев А. А. Комбинированный метод внутривенного лазерного облучения крови в лечении больных с воспалительными заболеваниями печени, желчных протоков и поджелудочной железы. 1988.
14. Мостовников В. А., Мостовникова Г. Р., Плавский В. Ю. и др.. Фотофизический механизм терапевтического действия низкоинтенсивного лазерного излучения. 1991.
15. Никулин М. А., Козлов В. Г., Васильев А. Г. Субмолекулярные механизмы биологического действия излучения гелий-неонового лазера. 1991.
16. Павлов С. Е., Кузнецова Т. Н. Методика применения физиотерапевтических средств (низкоэнергетических ИК-лазеров) в тренировочном процессе пловцов. 1997.
17. Павлов С. Е. Повышение физической работоспособности пловцов с использованием метода полизонального транскутанного лазерного воздействия. 1998.
18. Павловский М. П., Орел Г. Л., Варивода Е. С. Использование низкоинтенсивного лазерного излучения в лечении хронических заболеваний печени. 1988.
19. Пикуза В. И., Илларионов В. Е., Сапукевич В. Н. Влияние магнитолазерного воздействия на предоперационную подготовку и течение послеоперационного периода при холецистэктомии у больных желчнокаменной болезнью. 1992;
20. Потапов А. С., Банкова В. В. Состояние клеточных мембран у детей с хронической патологией печени и желудка на фоне лечения полупроводниковым лазером. 1991.
21. Приз А. Н. Хирургическое лечение холецистита с использованием лазеров. 1991.
22. Применение низкоинтенсивных лазеров в клинической практике / Под ред. О. К. Скобелкина. 1997.




